情報誌 花王ハイジーンソルーション No.28
(2023年3月)
サル痘
岡山理科大学 獣医学部 微生物学 教授/国立感染症研究所 名誉所員
森川 茂
1.はじめに
サル痘は、1958年にコペンハーゲンの国立血清学研究所でカニクイザルの天然痘様の感染症として報告され、その後、何回かサル施設のサルで流行している(致死率は3〜48%)1,2)。人のサル痘は1970年にザイール(現在のコンゴ民主共和国(DRC))で初めて報告された3)。天然痘のワクチン接種が行われなくなるとDRCなどでは年々サル痘患者数が増加している4)。ナイジェリアでは2017年以降流行が継続していて5,6)、2018年以降ナイジェリアからの帰国者が英国などで輸入症例として数回報告されている4,7)。今年(2022年)、5月に欧州でサル痘患者が報告されて以降、急激に患者数が増加したことから8)、7月にWHOがサル痘を「国際的に懸念される公衆衛生上の緊急事態」と宣言した。第三世代の天然痘ワクチンであるMVA-BNの接種などにより新規患者数は減少傾向となったが、これまでに非流行国の103カ国で81,000人以上のサル痘患者が確認され、51名が死亡している。本稿では、サル痘患者がアフリカの流行国で増加した理由、世界中で患者が急増した理由、対応策やワクチンなどについて概説する。
2.天然痘根絶とサル痘患者の増加
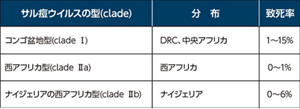
サル痘ウイルスは、天然痘(痘そう)ウイルスに近縁なポックスウイルス科オルソポックスウイルス属のウイルスで、強毒なコンゴ盆地型(clade I, 致死率が1~15%)、比較的弱毒な西アフリカ型(clade IIa, 致死率1%未満)のウイルスが知られていた。2017年からナイジェリアで流行しているサル痘(致死率0~6%)は、旧来の西アフリカ型とは遺伝的にやや異なるウイルスによることから、別のクレード(clade IIb)に分類されている(表1)8,9)。天然痘は自然感染では人だけが感染するが、サル痘はアフリカのげっ歯類が宿主と考えられる人獣共通感染症で、多くの動物に感染する4)。
オルソポックスウイルス属のウイルスの遺伝子は、200種程度の蛋白質をコードしているが、そのうち半分ほどは構造蛋白質で、ウイルス種間で非常に良く保存されていて、強い交差免疫が誘導される。1980年に、世界保健機構(WHO)により天然痘は根絶が宣言されたが、天然痘ワクチンは、弱毒化した天然痘ウイルスではなく、英国のEdward Jennerが1796年に牛痘ウイルスを用いて開発したとされる。天然痘ワクチンに用いるウイルスはワクチニアウイルスと呼ばれるが、これは牛痘ウイルスや馬痘ウイルスに近縁で、継代中に変異や組換えなどにより生じたウイルスと考えられる。1970年代になると多くの国で天然痘は根絶され、それに伴いワクチンの定期接種も停止された。日本では1975年以降に生まれた世代はワクチンを接種されていない。これに伴い免疫のない人口が増加するにつれ、DRCなどのサル痘常在国では徐々にサル痘患者が増加してきた。1980年代のDRCでのサル痘流行時の疫学調査から天然痘ワクチンのサル痘発症予防効果は85%と報告されている10)。天然痘根絶20年後にあたる2000年以降、特にDRCでのサル痘患者が急増し、2000年から2009年の10年間の推定患者数は10,027人、2010年から2019年では18,788人と報告されている4)。ナイジェリアでは2017年からサル痘の流行が毎年おきていて、2018年からはナイジェリアからの帰国者が海外で発症する輸入症例のサル痘患者が英国、シンガポール、イスラエル、米国で報告されているが、輸入症例からの二次感染は極めて限定的であった4,7)。このことから、天然痘ワクチンの停止は、アフリカの常在地での患者増加の原因の一つと考えられる。
表1 サル痘ウイルスの型と分布


3.動物を介したサル痘の流行
サル痘ウイルスは、アフリカのげっ歯類が自然宿主と考えられているが、多くの動物に感受性があるため自然宿主の動物種は未だ同定されていない。疫学的にはclade Iのサル痘ウイルスが強毒で、clade IIa, IIbのサル痘ウイルスがやや弱毒である。カニクイザルへの実験感染では、clade Iもclade IIaのサル痘ウイルスも致死的感染を起こすが前者がより強毒である11)。2003年に、ガーナから米国のテキサスに愛玩用に輸入されたアフリカのげっ歯類(アフリカオニネズミ、アフリカヤマネなど)から動物商の施設で北米原産のプレーリードッグにサル痘ウイルスがおそらく飛沫感染し、プレーリードッグを愛玩用に購入した人から47名のサル痘患者が発生した12,13)。このときの流行はclade IIaのサル痘が原因で、全てがプレーリードッグからの感染で二次感染はなかった。ガーナから米国のテキサスに愛玩用に輸入されたアフリカヤマネの一部は日本に輸出されたことが米国疾病対策センター(CDC)の調査で判明し、輸入された動物を回収してサル痘ウイルス感染の有無をPCR、ウイルス分離、抗体検出で調べた結果、全て陰性であった。
4.流行国でのサル痘
DRCなどの流行国では、子供のサル痘患者が多く、野生のげっ歯類を捕獲する際の咬傷や、これらの動物の血液などとの接触により感染すると考えられている(図1)。サル痘患者からの二次感染は限定的で通常は感染者限りか家族内感染程度で人から人への感染は終わるが、最も多い場合でも人から人への感染は7世代までと報告されている14)。DRCのサル痘ウイルスは強毒なclade Iで、小児、妊婦、免疫不全者は重症化するリスクが高い。小児ではサル痘と水痘の重複感染例も多く報告されているが、重症化への寄与は不明である。種痘停止後年数が経過するにつれて患者の年齢が高くなってきた。これは天然痘ワクチン停止後に免疫的にナイーブな人口が増加し、年齢も高くなってきたためと考えられる。一方、2017年からナイジェリアで毎年clade IIbによるサル痘が流行していて、患者の年齢の中央値は29歳で、HIV感染者で抗ウイルス薬治療を受けていない患者が重症化し死亡することが多い。致死率は最大で6%と報告されている7)。また、ナイジェリアの流行では、動物からの感染よりも患者からの感染が多くなっている。
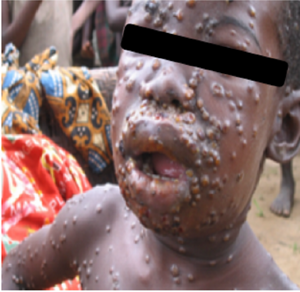
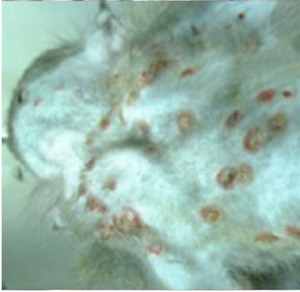
流行国でのサル痘は、潜伏期間(5〜21日、平均12日)の後、発熱(38°C以上)、発汗、頭痛、悪寒、背部痛、筋肉痛、無力感、咽頭痛、リンパ節腫脹などが現れる。リンパ節腫脹はサル痘に特徴的な所見で天然痘では認められない。発熱後1〜3日以内に皮疹が現れる。発疹は体幹よりも顔面や四肢に集中し、顔面(96%)、手のひら・足の裏(90%)に認められる。口腔粘膜(70%)、生殖器(30%)、結膜(20%)および角膜などに病変がでることもある(図1)15)。皮疹は、水疱、膿疱、痂皮へと2週間から4週間程度で移行して脱落し瘢痕化して回復する。死亡症例では脳炎や細菌などの二次感染などが認められることがある。皮疹の数は数個から数千個とさまざまであるが、殆どの皮疹の進行が同期的である。
図1 人とカニクイザルのサル痘の皮疹
コンゴ民主共和国の患者(Prof. JJ Muyembe-Tamfumより)とサル痘ウイルスを実験感染したカニクイザルの皮膚病変
5.非流行国でのサル痘の大流行
サル痘はアフリカの流行国以外では稀な感染症であった。しかし、2022年5月初旬に英国でサル痘患者が確認された後、まずEU諸国でサル痘患者が急激に増加し、その後世界各国で患者が報告されてきた。2022年11月末時点での、アフリカの流行国以外でのサル痘患者数は103カ国で81,048人報告され、51名が死亡している(図2)16)。日本ではサル痘は感染症法で四類感染症に指定されていて全症例報告義務があり、これまでに7人の患者が報告されている。現在、世界中で流行しているサル痘は、ナイジェリアのclade IIbのサル痘ウイルスによる7)。現在の流行では人から人への感染がおそらく22世代以上継続していることから、人に馴化したサル痘ウイルスの出現が危惧される。また、患者から野生のげっ歯類などへ感染が広がると、その地域がサル痘常在地域になるリスクがある。患者数の急増と、これらのリスクを考慮して7月23日にWHOはサル痘を「国際的に懸念される公衆衛生上の緊急事態」とした。非流行地で流行しているサル痘は、患者の年齢層や性別に加え、臨床症状もアフリカの流行地でのサル痘と異なる。非流行地で流行しているサル痘は、患者の年齢の中央値は38歳の男性で、90%以上がゲイ、バイセクシャル、または男性と性交する男性(MSM)で、HIV感染(36〜41%)、抗HIV薬治療(90%以上)、性感染症(30%)などの特徴がある。皮膚病変部位は、性器・肛門周辺に多く、顔や手足の病変は少ない(10%)が口の周辺や口腔内の病変は多い。また、皮疹のステージが異なる症例が36%、孤立性の病変(11%)や紅斑性丘発疹(14%)を呈する患者もいる。また、直腸痛(直腸炎を含む)を呈する患者が40%程と報告されている17,18)。このような旧来のサル痘との相違は、感染経路がMSM間での性交渉に伴う皮膚と皮膚の接触部位に病変が好発しているためと考えられている。天然痘は主に飛沫感染により感染するが19)、サル痘では病変部位との接触あるいは患者の皮膚病変などに触れた衣類やリネンとの接触が主な感染経路である。ドイツの入院患者の調査では、患者が頻繁に触れた場所がウイルスに高度に汚染していた20)ことから、患者あるいは感染が疑われる人との、皮膚と皮膚の接触や間接的接触を避けることが感染予防として重要である。また、患者の直接触れた箇所の消毒も重要である。サル痘ウイルスは脂質膜を持つウイルスであり、アルコール消毒や界面活性剤などで容易に不活化できる。
図2 サル痘患者の累積患者数と新規患者数(7日平均)16)
6.ワクチンと治療薬とサル痘患者数の減少
天然痘ワクチンは非常に有効であるが、現在では受け入れられないほど強い副反応が出ることがあった。そこで、天然痘根絶後にバイオテロ対策として安全で有効なワクチンが開発され、第三世代天然痘ワクチンと呼ばれていて、デンマークのMVA-BN21)と日本の LC16m8株22)によるワクチンの2種類がある。日本では、天然痘根絶前に種痘に広く使用されていたLister株ワクチニアウイルスをさらに弱毒化したLC16m8株を用いたワクチン(乾燥細胞培養痘そうワクチン)が1975年に承認された。厚生労働省は、本ワクチンをサル痘の予防にも適用範囲を拡大することを承認した。MVA-BN株による天然痘ワクチンが、欧米などではサル痘予防ワクチンとしても承認され、米国、欧州、イスラエルなどで、多数の性交渉者をもつハイリスクなMSMなどに接種されており、米国では既に100万人近くが少なくとも1回接種されていて、1回接種2週後のサル痘発症防御能は93%と報告されている23)。イスラエルの調査ではサル痘発症防御能79%と報告されている24)。日本の乾燥細胞培養痘そうワクチンは、カニクイザルへの致死的サル痘ウイルス感染モデルでの有効性評価はされているが25)、人のサル痘流行での評価はされていない。ワクチン接種が進むにつれて新規サル痘患者の発生数が世界的に減少している(図2)。
7.おわりに
非流行国でサル痘患者が急増し大きな問題となったが、患者発生数は減少傾向が明らかになってきた(図2)。これは、患者の早期診断と(自己)隔離の徹底、効果的な接触者追跡、適切な天然痘ワクチン接種戦略などが寄与していると考えられる。今回のサル痘流行は終息できる可能性が高い。しかし、今回の世界的なサル痘流行のindex caseは特定されておらず、未同定の患者からの感染があったと考えられる。また、米国での流行は大部分が5月上旬から流行しているclade IIbのサル痘ウイルスによるが、2021年の輸入症例から検出されたclade IIbのサル痘に由来すると考えられるサル痘患者が一定程度いることから、輸入症例あるいは未同定の感染者からのサル痘感染が1年以上検出されずに継続していたとも考えられる。また、今後、より強毒なコンゴ盆地型によるサル痘が流行するリスクも排除できないため、継続した監視体制が必要である。サル痘患者から犬への感染がフランスとブラジルで確認されているため、動物への感染にも留意する必要がある26)。
1) von Magnus P, Andersen EK, Petersen KB, et al. A pox-like disease in cynomolgus monkeys. Acta Pathol Microbiol Scand 1959;46:156-76.
2) Arita I, Henderson DA. Smallpox and monkeypox in non-human primates. Bull World Health Organ 1968;39:277-83.
3) Ladnyj ID, Ziegler P, Kima E. A human infection caused by monkeypox virus in Basankusu Territory, Democratic Republic of the Congo. Bull World Health Organ. 1972;46:593-597.
4) Bunge EM, Hoet B, Chen L, et al. The changing epidemiology of human monkeypox-A potential threat ? A systematic review. PLoS Negl Trop Dis. 2022;16(2):e0010141.
5) Mauldin MR, McCollum AM, Nakazawa YJ, et al. Exportation of monkeypox virus from the African Continent. J Infect Dis. 2022;225:1367-76.
6) Nguyen PY, Ajisegiri WS, Costantino V, et al. Reemergence of human monkeypox and declining population immunity in the context of urbanization, Nigeria, 2017-2020. Emerg Infect Dis. 2021 Apr;27(4):1007-1014. doi: 10.3201/eid2704.203569.
7) Yinka-Ogunleye A, Aruna O, Dalhat M, et al. Outbreak of human monkeypox in Nigeria in 2017-18: a clinical and epidemiological report. Lancet Infect Dis. 2019; 19:872-9.
8) Kluge H, Ammon A. Monkeypox in Europe and beyond - tackling a neglected disease together. Euro Surveill. 2022; 27:2200482.
9) Isidro J, Borges V, Pinto M, Sobral D, Santos JD, Nunes A, Mixão V, Ferreira R, Santos D, Duarte S, Vieira L, Borrego MJ, Núncio S, de Carvalho IL, Pelerito A, Cordeiro R, Gomes JP. Phylogenomic characterization and signs of microevolution in the 2022 multi-country outbreak of monkeypox virus. Nat Med. 2022;28(8):1569-1572.
10) Fine PEM, Jezek Z, Grab B, et al. The transmission potential of monkeypox virus in human populations. Int J Epidemiol. 1988; 17(3): 643-50
11) Saijo M, Ami Y, Suzaki Y, et al. Virulence and pathophysiology of the Congo Basin and West African strains of monkeypox virus in non-human primates. J Gen Virol. 2009;90(Pt 9):2266-71.
12) Bernard SM, Anderson SA. Qualitative assessment of risk for monkeypox associated with domestic trade in certain animal species, United States. Emerg Infect Dis. 2006;12(12):1827-33.
13) Reed KD, Melski JW, Graham MB, Regnery RL, Sotir MJ, Wegner MV, Kazmierczak JJ, Stratman EJ, Li Y, Fairley JA, Swain GR, Olson VA, Sargent EK, Kehl SC, Frace MA, Kline R, Foldy SL, Davis JP, Damon IK. The detection of monkeypox in humans in the Western Hemisphere. N Engl J Med. 2004;350(4):342-50.
14) Nolen LD, Osadebe L, Katomba J, et al. Extended Human-to-Human Transmission during a Monkeypox Outbreak in the Democratic Republic of the Congo. Emerg Infect Dis. 2016 Jun;22(6):1014-21. doi: 10.3201/eid2206.150579.
15) Monkeypox. WHO. https://www.who.int/news-room/fact-sheets/detail/monkeypox
16) https://www.cdc.gov/poxvirus/monkeypox/response/2022/world-map.html
17) Thornhill JP, Barkati S, Walmsley S, et al. Monkeypox Virus Infection in Humans across 16 Countries - April-June 2022. N Engl J Med. 2022 Jul 21.
18) Patel A, Bilinska J, Tam JCH, et al. Clinical features and novel presentations of human monkeypox in a central London centre during the 2022 outbreak: descriptive case series. BMJ. 2022; 378:e072410.
19) Nicas M, Hubbard AE, Jones RM,et al. The Infectious Dose of Variola (Smallpox) Virus. Applied Biosafety, 2004; 9(3):118-127.
20) Nörz D, Pfefferle S, Brehm TT, et al. Evidence of surface contamination in hospital rooms occupied by patients infected with monkeypox, Germany, June 2022. Euro Surveill. 2022;27(26). doi: 10.2807/1560-7917.
21) Frey SE, Winokur PL, Salata RA, et al. Safety and immunogenicity of IMVAMUNE® smallpox vaccine using different strategies for a post event scenario. Vaccine. 2013 Jun 24;31(29):3025-33.
22) Eto A, Saito T, Yokote H, et al. Recent advances in the study of live attenuated cell-cultured smallpox vaccine LC16m8. Vaccine. 2015 Nov 9;33(45):6106-11.
23) Payne AB, Ray LC, Kugeler KJ, et al. Incidence of Monkeypox Among Unvaccinated Persons Compared with Persons Receiving ≥1 JYNNEOS Vaccine Dose - 32 U.S. Jurisdictions, July 31-September 3, 2022. MMWR Morb Mortal Wkly Rep. 2022 Oct 7;71(40):1278-1282.
24) Ronen Arbel, Yael Wolff Sagy, Roy Zucker, et al. Effectiveness of a single-dose Modified Vaccinia Ankara in Human Monkeypox: an observational study. https://doi.org/10.21203/rs.3.rs-1976861/v2
25) Saijo M, Ami Y, Suzaki Y, et al. LC16m8, a highly attenuated vaccinia virus vaccine lacking expression of the membrane protein B5R, protects monkeys from monkeypox. J Virol. 2006;80(11):5179-88.
26) Sophie Seang , Sonia Burrel, Eve Todesco, et al. Evidence of human-to-dog transmission of monkeypox virus. Lancet 2022; 400(10353):658-659.
Contact
お問い合わせ・ご相談
![]()
手指衛生・環境衛生に関するお問い合わせはこちら
サイトの掲載内容に関するお問い合わせ、製品に関するご不明点などは下記からお問い合わせください
電話・FAXによるお問い合わせ
営業時間/9:00~12:00、13:00~16:00
(土・日・祝日・年末年始・夏季休業を除く)
ご返信できますようお客様の氏名、
電話番号、ファクシミリ番号をご記入下さい
お電話の混雑状況によって、つながりにくい場合がございますので、
メールによるお問い合わせも併せてご利用ください。
ご不便とご迷惑をおかけいたしますが、ご理解賜りますようお願い申し上げます。
製品の誤飲・誤食、製品が目に入ったなど、緊急の場合は、すぐ医療機関にご相談ください。
また、製品サポート・Q&Aもご参照ください。