- 学術情報・ハイジーンソルーション
- 情報誌 花王ハイジーンソルーション
- No.29 環境衛生と持続的環境消毒/排尿障害に対する理学療法士の役割(2023年7月)|花王ハイジーンソルーション
- 環境衛生と持続的環境消毒|花王ハイジーンソルーション
情報誌 花王ハイジーンソルーション No.29
(2023年7月)
環境衛生と持続的環境消毒
東北大学大学院医学系研究科総合感染症学分野・講師
金森 肇
1.はじめに
医療施設において環境、水、空調に関連した院内感染事例やアウトブレイクが世界中で報告されており、汚染された医療環境から微生物の伝播および医療関連感染を予防する必要がある。米国の医療施設でCOVID-19の医療関連感染への影響を調査した論文では、コロナ禍で中心静脈カテーテル関連血流感染(CLABSI)、尿道留置カテーテル関連尿路感染(CAUTI)、多剤耐性菌感染(MRSA、VRE、多剤耐性グラム陰性桿菌)の増加を認めており、COVID-19に特化した対策だけでなく、医療関連感染や薬剤耐性菌に対する感染対策の重要性を示唆した(Baker 2022)。本稿では感染対策における環境衛生について概説する。
2.環境リザーバと病原体
病室の汚染された環境表面は多剤耐性菌の伝播のリザーバであり、病室清掃後も薬剤耐性菌による頻繁な汚染が生じる。微生物の生存期間は、温度や湿度によって大きく変わるが、多剤耐性菌は数日から数週間の長期間、環境表面で生存可能であり、汚染された環境表面や医療器具は多剤耐性菌の伝播の媒介物となりうる。MRSA、VRE、Acinetobacter、Clostridioides difficileなどの芽胞形成菌は、乾燥した環境表面でも生存期間が比較的長いとされる(図1)。
図1 医療環境表面のドライ・バイオフィルム
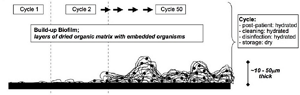
Reprinted from Comput Biol Med, 39, Zhonga W, Alfa M, Howie R, Zelenitsky S. ,Simulation of cyclic reprocessing buildup on reused medical devices, 569.,
Copyright (2009), with permission from Elsevier
医療環境表面で見られるドライ・バイオフィルムはウェット・バイオフィルムと異なり、微生物および有機物(清掃、消毒、乾燥保管後)が不均一に蓄積して形成され、乾燥・熱・消毒薬に耐性傾向を示す(Zhonga 2009; Alfa 2019)。病院間で微生物種の組成が異なり、Staphylococcus(MRSA含む)、Bacillus、Acinetobacterなどが検出される。培養困難であるが、生菌の存在、周期的に細菌を放出しうる。ドライ・バイオフィルムは医療環境表面から高頻度に検出され、環境表面や医療器具の清掃・消毒を困難にさせる要因である可能性が指摘されており、微生物伝播におけるドライ・バイオフィルムの役割を解明する必要がある。
医療環境を介した微生物伝播に関する臨床研究もすでに実施されており、薬剤耐性菌に感染あるいは保菌していた患者の病室に新たな患者が入院する場合、耐性菌獲得のリスクが増加する(Weber, Kanamori 2016)。また、病室内環境が十分に清掃されていないことや、清掃を改善する介入を行った研究においても、一定の割合で環境表面の汚染が認められる。このように、微生物で汚染された病室内の環境表面や医療器具に患者や医療従事者が触れることで、院内伝播を生じる。患者から医療従事者の手指を介して、あるいは汚染された医療環境の媒介物により別の患者へ微生物が伝播するため、手指衛生と環境衛生は切り離すことができない(Otter 2011)(図2)。
実際に環境表面や医療器具を介した医療関連感染やアウトブレイクが世界中で報告されている(Kanamori 2017)。実に様々な環境リザーバ(表1)と微生物(グラム陰性菌、特に多剤耐性菌)が関係しており、不適切な環境清掃・消毒によって微生物伝播や医療関連感染につながる。
最近では、ドップラー超音波や心電図などのポータブル医療器具が医療現場で多用されるようになったが、使用後の清掃・消毒が不十分だと媒介物になり得る(John 2017)。また、水回りの環境や水を使用する器具の汚染は微生物(レジオネラ、緑膿菌、アシネトバクター、非結核性抗酸菌など)の温床となるため、水系リザーバの環境対策も重要である(Kanamori 2016)。日本においても、感染防止対策加算1届出病院では薬剤耐性グラム陰性桿菌のアウトブレイクを約3割の施設が経験し、その約6割が環境や器材の汚染との関連(手洗いシンク、排水口、尿取り扱い、トイレ、呼吸器関連など)と回答している(厚労省科研 2017)。
図2 衛生プラクティス
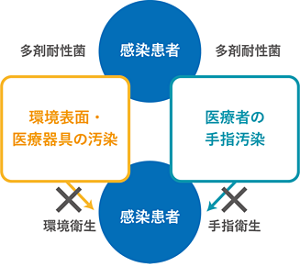
Infect Control Hosp Epidemiol 2011;32:687-99を基に作成
表1 環境リザーバと病原微生物
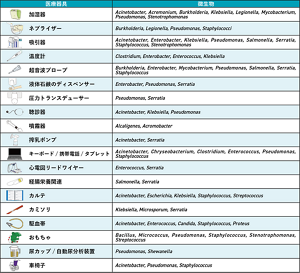


Kanamori, et al. Clin Infect Dis. 2017;65:1412-19を基に作成
3.環境衛生について
病原微生物の除去・殺菌を目的とした清掃活動が環境衛生であり、環境整備という言葉よりも医療環境の包括的な衛生プラクティスである。環境衛生には、病室の環境表面や医療器具の見た目の汚れを落とす物理的清掃、微生物の減少を目指した衛生的清掃、環境消毒(消毒薬、ノータッチ・メソッド)がある(Carling 2016)(図3)。
図3 環境衛生とは
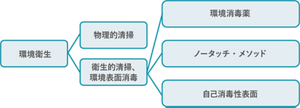
Infect Dis Clin North Am 2016;30:639-60を基に作成
病院清掃(hospital cleaning)には、患者入院中に毎日行う日常清掃(daily cleaning)と、患者退院時に行う退院時清掃(terminal cleaning)がある。病院清掃の標準化や清潔の基準は定まっていないため、病院清掃cleaningと清潔cleanlinessに関する科学的なエビデンスが求められている。
医療環境の清掃・消毒に関する方針には、1.病院全体で病室および医療器具の清掃・消毒を標準化する、2.病院用消毒薬を使用する、3.接触表面と医療器具を毎日および汚れている時に清掃する、4.共有ポータブル器具(車椅子、心電図、ポータブルX線装置、血糖値測定器、血圧カフ等)の清掃手順を決める、5.最も清潔な場所から最も汚染された場所へ清掃する、部屋毎にクリーニングクロスを交換し、少なくとも3枚のクロスを使用する、6.消毒剤・洗剤で湿ったモップで床を拭く、7.消毒剤が現場で用意されている場合、正しい濃度を記録する、8.ワイプおよび液体消毒剤の殺菌時間に対処する、9.清掃スタッフは個人防護具の訓練を受け、遵守することが含まれる(Rutala, Weber 2019)。清掃の遵守率の向上も重要であり、ある研究では清掃の遵守率が8割以上の場合、MRSA、VRE、C.difficileなどの微生物による感染率の低下を認めた(Alfa 2015)。また、病室の清掃バンドル(5つの構成要素:コミュニケーション、スタッフトレーニング、清掃監視、製品使用、清掃技術)を用いたResearching Effective Approaches to Cleaning in Hospitals(REACH)研究が実施され、清掃の遵守率を改善させ、VRE感染症の発生率や黄色ブドウ球菌菌血症の発生率の減少が報告された(Mitchell 2019)。医療施設の日常清掃および退院時清掃のプラクティスを強化し、病院清掃の遵守率を改善することで、汚染された病室環境を介した微生物伝播や薬剤耐性菌による医療関連感染の予防が期待されている。
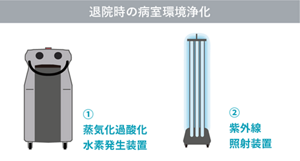
近年、病室内の環境表面におけるバイオバーデンを減少させるため、ノータッチ・メソッド(非接触型環境消毒法)を用いた病室内環境消毒に関心が寄せられている。ノータッチ・メソッドの中でも紫外線照射装置と蒸気化過酸化水素発生装置の環境消毒効果に関する基礎的および臨床的なエビデンスが蓄積されてきており、すでに医療現場で活用されている。(Weber, Kanamori 2016; Anderson 2017; Kanamori 2021)。
4.持続的環境消毒
病室の環境清掃・消毒は毎日行われているが、清掃・消毒の効果は一時的であり、清掃・消毒後に時間経過とともに微生物が再増殖したり、患者や医療従事者が病室内の環境表面や医療器具に触れることによって病原性微生物で再び汚染されていく。このため、持続的に環境消毒効果を示す消毒薬や環境浄化技術、環境表面自体に消毒効果のある素材の研究開発が行われている(Weber 2019)。
理想的な消毒薬には次のような15の要素が挙げられ、1.幅広いスペクトル(医療関連感染の一般的な原因微生物を含む抗微生物スペクトルを有する)、2.即効性(殺菌時間が短い)、3.十分なウェット時間(ワイプやスプレーで殺菌時間を満たすのに十分な時間、表面をウェット状態に保つ)、4.環境要因の影響が少ない(血液、喀痰、便等有機物の存在下で活性があり、石鹸や洗剤と適合する)、5.非毒性(ユーザー、面会者、患者への刺激性がなく、アレルギー反応を誘発しない)、6.環境表面適合性(一般的な医療環境表面と器具と適合する)、7.持続性(使用された表面に持続的な抗微生物活性を有する)、8.使いやすい(ワイプのサイズ、スプレー等の複数の形態で利用可能、使用方法はシンプルで必要に応じて個人防護具に関する情報あり)、9.許容できる臭い、10.経済的(消毒剤の性能、使用毎のコスト)、11.溶解度、12.安定性、13.クリーナー(良好なクリーニング特性を有する)、14.不燃性、15.臨床での有効性(医療機関で環境汚染の減少や医療関連感染の減少を示すエビデンス)である(Rutala, Weber 2019)。
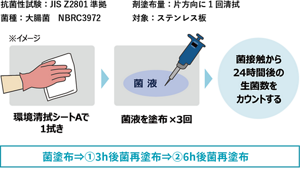
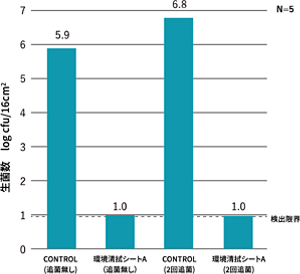
第四級アンモニウム化合物は、医療環境表面の低レベル消毒に広く使用されているが、コンピュータ・キーボードの消毒に関する研究で、試験した3種類の第四級アンモニウム化合物はVREに対して優れた抗菌活性を示し、48時間の試験期間中、抗菌活性が維持された(Rutala 2006)。また、第四級アンモニウム塩の抗菌特性を実用的に使いこなすには、様々な要素技術が必要であることは考えられるが、環境清拭シートA(第四級アンモニウム塩系抗菌技術)で1回清拭後、大腸菌の菌液をステンレス板に塗布し、その後菌液を追加で2回塗布(3時間後、6時間後)し、24時間後に評価した実験では、大腸菌は検出限界以下を示し、抗菌活性の持続が観察された。
図4 環境清拭シートA(第四級アンモニウム塩系抗菌技術)の抗菌活性の検討
さらに、第四級アンモニウムオルガノシランをICUのベッドや柵、壁、布製の椅子、布などにスプレーして、環境表面にコーティングすると、細菌数および耐性菌を15週以上、持続的に減少した(Tamini 2014)。
消毒効果の高い紫外線照射装置を用いて患者退室後に一時的に環境浄化を行うことに加えて、患者在室中にも実施できる持続的な環境浄化技術の研究開発も行われている。高輝度狭帯域光照射装置は、発光ダイオードからの特殊な可視光を活用したもので、高輝度狭帯域光(405nm)が細菌内のポルフィリン分子の光励起を起こし、活性酸素が作られて、環境消毒効果を発揮する。患者や医療従事者が病室にいる間も照射可能で、持続的な環境浄化が可能である。強化合成樹脂表面のMRSA, VRE, Acinetobacter, C. difficileに対する72時間の消毒効果の検討では、消毒効果はゆるやかではあるものの、ブルーライトはMRSA, VRE, Acinetobacter, C. difficileに持続的な消毒効果、ホワイトライトはCDを除いて持続的な消毒効果を認めた(Rutala 2018)。
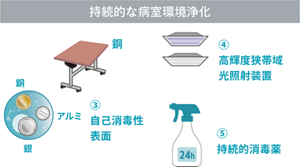
銅、銀、シャークレットなどの自己消毒性表面に関しても研究されている。小児集中治療室における銅合金表面を使用した病室の検討では、銅合金群で菌量は減少し、コントロール群と比較して有意差はなかったが、医療関連感染の減少を約2割認めた(von Dessauer 2016)(図5)。
図5 持続的環境消毒
Curr Opin Infect Dis 2016;29:424-31を基に作成
5.おわりに
医療環境汚染が多剤耐性菌などの微生物の伝播に重要な役割を担っているため、医療環境対策を強化していく必要がある。医療環境対策においてプラクティスとプロダクトがともに重要であり、エビデンスに基づく環境衛生の実践が求められている。医療環境の清掃・消毒ベストプラクティス、新しい環境浄化技術や持続的環境消毒に関する研究の発展が期待される。
1) Baker MA, Sands KE, Huang SS, Kleinman K, Septimus EJ, Varma N, Blanchard J, Poland RE, Coady MH, Yokoe DS, Fraker S, Froman A, Moody J, Goldin L, Isaacs A, Kleja K, K orwek KM, Stelling J, Clark A, Platt R, Perlin JB; CDC Prevention Epicenters Program. The Impact of Coronavirus Disease 2019(COVID-19) on Healthcare-Associated Infections. Clin Infect Dis. 2022;74:1748-54.
2) Zhonga W, Alfa M, Howie R, Zelenitsky S. Simulation of cyclic reprocessing buildup on reused medical devices.Comput Biol Med 2009;39:568-77.
3) Alfa MJ. Biofilms on instruments and environmental surfaces: Do they interfere with instrument reprocessing and surface disinfection? Review of the literature. Am J Infect Control. 2019;47S:A39-A45.
4) Weber DJ, Kanamori H, Rutala WA. 'No touch' technologies for environmental decontamination: focus on ultraviolet devices and hydrogen peroxide systems. Curr Opin Infect Dis. 2016;29:424-31.
5) Otter JA, Yezli S, French GL. The role played by contaminated surfaces in the transmission of nosocomial pathogens. Infect Control Hosp Epidemiol. 2011;32:687-99.
6) Kanamori H, Rutala WA, Weber DJ. The Role of Patient Care Items as a Fomite in Healthcare-Associated Outbreaks and Infection Prevention. Clin Infec Dis. 2017.65:1412-19.
7) John A, Alhmidi H, Cadnum JL, Jencson AL, Donskey CJ. Contaminated Portable Equipment Is a Potential Vector for Dissemination of Pathogens in the Intensive Care Unit. Infect Control Hosp Epidemiol. 2017;38:1247-9.
8) Kanamori H, Weber DJ, Rutala WA. Healthcare Outbreaks Associated With a Water Reservoir and Infection Prevention Strategies. Clin Infect Dis. 2016;62:1423-35.
9) 厚生労働科学研究費補助金(新興・再興感染症及び予防接種政策推進研究事業)平成29年度分担研究報告書(飯沼由嗣)薬剤耐性グラム陰性桿菌に対する感染制御に関する研究−病院環境との関連について
10) Rutala WA, Weber DJ. Best practices for disinfection of noncritical environmental surfaces and equipment in health care facilities: A bundle approach. Am J Infect Control. 2019;47S:A96-A105.
11) Alfa MJ, Lo E, Olson N, MacRae M, Buelow-Smith L. Use of a daily disinfectant cleaner instead of a daily cleaner reduced hospital-acquired infection rates. Am J Infect Control. 2015;43:141-6.
12) Mitchell BG, Hall L, White N, Barnett AG, Halton K, Paterson DL, Riley TV, Gardner A, Page K, Farrington A, Gericke CA, Graves N. An environmental cleaning bundle and health-care-associated infections in hospitals(REACH): a multicentre, randomised trial. Lancet Infect Dis. 2019;19:410-8.
13) Anderson DJ, Chen LF, Weber DJ, et al. Enhanced terminal room disinfection and acquisition and infection caused by multidrug-resistant organisms and Clostridium difficile(the Benefits of Enhanced Terminal Room Disinfection study): a cluster-randomised, multicentre, crossover study. Lancet. 2017;389(10071):805-14.
14) Kanamori H, Rutala WA, Gergen MF, Sickbert-Bennett EE, Knelson LP, Anderson DJ, Sexton DJ, Weber DJ. Microbial Assessment of Health Care-Associated Pathogens on Various Environmental Sites in Patient Rooms After Terminal Room Disinfection. Open Forum Infect Dis. 2021;8:ofab008.
15) Weber DJ, Rutala WA, Sickbert-Bennett EE, Kanamori H, Anderson D; CDC Prevention Epicenters Program. Continuous room decontamination technologies. Am J Infect Control. 2019;47S:A72-8.
16) Rutala WA, White MS, Gergen MF, Weber DJ. Bacterial contamination of keyboards: efficacy and functional impact of disinfectants. Infect Control Hosp Epidemiol. 2006;27:372-7.
17) Tamimi AH, Carlino S, Gerba CP. Long-term efficacy of a self-disinfecting coating in an intensive care unit. Am J Infect Control. 2014;42:1178-81.
18) Rutala WA, Kanamori H, Gergen MF, Sickbert-Bennett EE, Sexton DJ, Anderson DJ, Laux J, Weber DJ; CDC Prevention Epicenters Program. Antimicrobial activity of a continuous visible light disinfection system. Infect Control Hosp Epidemiol. 2018;39;1250-3.
19) von Dessauer B, Navarrete MS, Benadof D, Benavente C, Schmidt MG. Potential effectiveness of copper surfaces in reducing health care-associated infection rates in a pediatric intensive and intermediate care unit: A nonrandomized controlled trial. Am J Infect Control. 2016;44:e133-9.
Contact
お問い合わせ・ご相談
![]()
手指衛生・環境衛生に関するお問い合わせはこちら
サイトの掲載内容に関するお問い合わせ、製品に関するご不明点などは下記からお問い合わせください
電話・FAXによるお問い合わせ
営業時間/9:00~12:00、13:00~16:00
(土・日・祝日・年末年始・夏季休業を除く)
ご返信できますようお客様の氏名、
電話番号、ファクシミリ番号をご記入下さい
お電話の混雑状況によって、つながりにくい場合がございますので、
メールによるお問い合わせも併せてご利用ください。
ご不便とご迷惑をおかけいたしますが、ご理解賜りますようお願い申し上げます。
製品の誤飲・誤食、製品が目に入ったなど、緊急の場合は、すぐ医療機関にご相談ください。
また、製品サポート・Q&Aもご参照ください。
- 学術情報・ハイジーンソルーション
- 情報誌 花王ハイジーンソルーション
- No.29 環境衛生と持続的環境消毒/排尿障害に対する理学療法士の役割(2023年7月)|花王ハイジーンソルーション
- 環境衛生と持続的環境消毒|花王ハイジーンソルーション